Lien vers la publication :
https://www.sciencedirect.com/science/article/abs/pii/S0969212623002897?dgcid=author
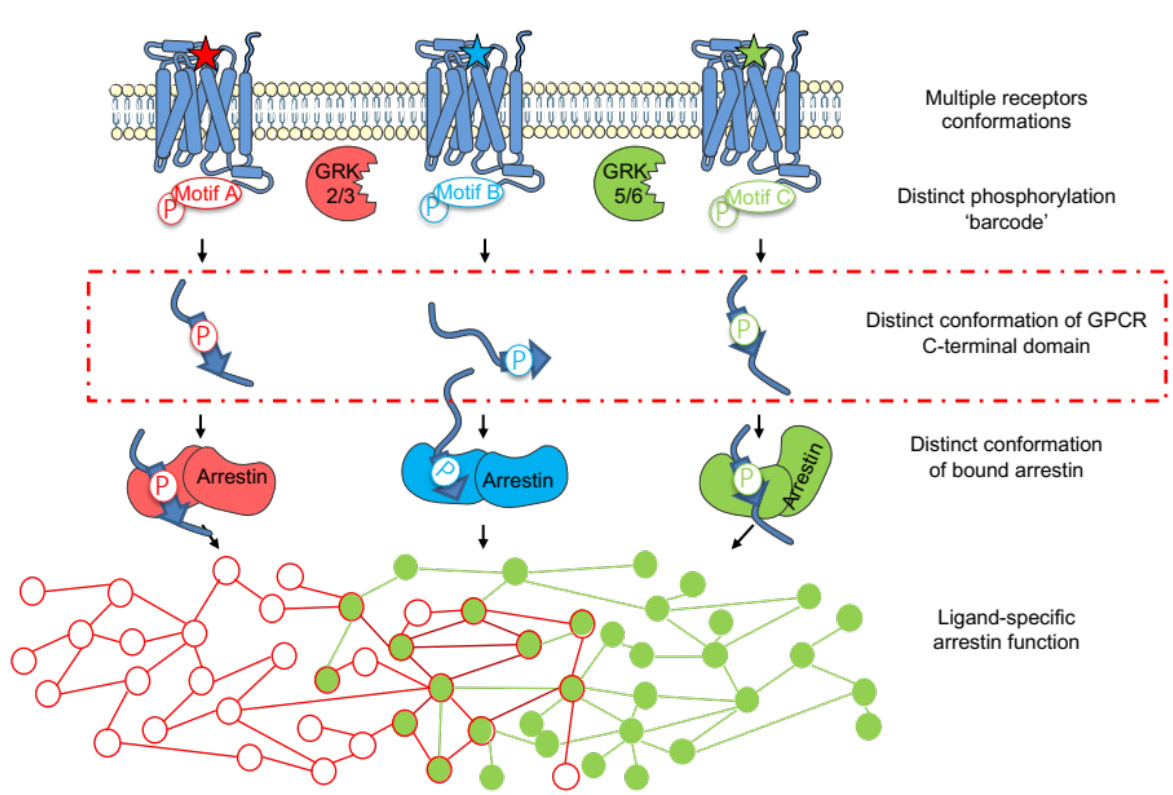
Les voies de signalisation des récepteurs couplés aux protéines G (RCPG) dépendant de l'arrestine est régulé par l'état de phosphorylation du domaine C-terminal du RCPG, mais les bases moléculaires de l'interaction arrestine-récepteur ne sont pas totalement éclaircies. Dans cette étude, nous avons exploré l’impact de la phosphorylation sur la conformation de la région C-terminale de trois RCPG de type rhodopsine (V2R, GHSR et β2AR). En utilisant des modèles phosphomimétiques, l’équipe de Nathalie Sibille, en collaboration avec l’équipe de Jean-Louis Banères (IBMM), a identifié des éléments de structure secondaire préformés, ou des motifs linéaires courts (SLiMs), qui subissent des transitions conformationnelles spécifiques lors de la phosphorylation. Il est important de noter que de telles transitions conformationnelles ont lieu dans la région interagissant avec l'arrestine-2. Ainsi, nos résultats suggèrent un modèle dans lequel la structuration dépendante de la phosphorylation des régions C-terminales des RCPGs modulerait la liaison à l'arrestine et, par conséquent la signalisation des voies dépendantes de l'arrestine. Il s'agit là d'un éclairage inédit apporté à la signalisation des RCPG dépendante de l'arrestine, processus central à la communication cellulaire.